近日,生命中心黄志伟教授课题组通过冷冻电镜和生化研究手段揭示了III型CRISPR-Cas系统的Csm复合体的近原子分辨率的结构以及其通过DNA和RNA核酸酶活性分别剪切RNA、DNA底物的分子机制。研究成果以“通过冷冻电镜和生化实验揭示三型CRISPR-Cas系统Csm复合物的DNase和RNase酶活性偶联机制”(Coupling of ssRNA cleavage with DNase activity in type III-A CRISPR-Csm revealed by cryo-EM and biochemistry)为题,于2月27日发表在《细胞研究》(Cell Research)杂志上。
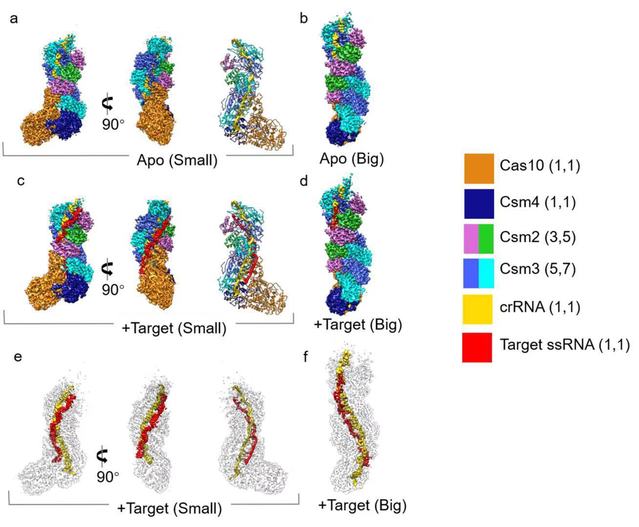
CRISPR/Cas系统是细菌和古细菌抵御外源入侵的一种适应性免疫机制。该系统通过剪切噬菌体的DNA或RNA从而防御噬菌体的入侵。III型 CRISPR-Cas系统分为III-A亚型和III-B亚型,III-A亚型称为Csm效应复合物,III-B亚型称为Cmr效应复合物,III-A亚型Csm复合物由5个Cas蛋白(Cas10、Csm2-5)和crRNA组成。为认识III-A亚型CRISPR/Cas系统降解单链DNA和RNA的分子机制,课题组解析了嗜热链球菌(Streptococcus thermophilus)III-A亚型 Csm复合物和Csm复合物与底物ssRNA的近原子分辨率的冷冻电镜结构,结合生物化学实验方法揭示了Csm复合物剪切DNA和RNA的分子机制,并提出Csm复合物的DNase和RNase酶活性偶联机制的模型。该研究发现底物ssRNA的3’端侧翼序列对激活Csm的DNase和RNase活性非常关键,它和Cas10接触通过別构调节从而剪切非特异性的单链DNA,当ssRNA与Csm复合物结合时激活该复合物剪切ssRNA和单链DNA,接着ssRNA被Csm复合物在远离3’端侧翼序列的位置剪切并从复合物解离,从而使得复合物降解DNA的活性失活。这种在一定时间窗口期激活DNase的方式,使得细菌利用该免疫系统可以有效防御噬菌体的入侵,同时也避免长时间激活DNase导致非特异剪切自身DNA。
黄志伟教授和美国斯坦福大学赵华(Wah Chiu)教授为研究论文的通讯作者,博士研究生郭明慧和斯坦福大学博士后张开明(Kaiming Zhang)为该论文的并列第一作者。本项目受到国家自然科学基金委、哈工大青年科学家工作室等基金的资助。
文章链接:https://www.nature.com/articles/s41422-019-0151-x